近日,深圳大學化學與環境工程學院朱蓓薇院士團隊在ACS Nano(中科院一區TOP期刊,影響因子15.8)上發表了題為“Lipid-Derived Electrophiles Modify Proteins and Alter Their Interfacial Behavior: The Distinct Mediating Role of the Interface”的研究論文。深圳大學副研究員龔維和博士后江楷煜為本論文的共同第一作者。深圳大學為本論文的第一通訊單位。

界面廣泛存在于生物體和各類食品中,各類界面(如液-液界面、氣-液界面等)的存在對生命活動的正常進行或食品品質的穩定維持具有重要意義。無論對于生物體還是食品,蛋白質不僅作為物質基礎直接參與界面的組成,也可通過向界面的擴散、吸附以及重排等一系列界面行為來行使其穩定界面的功能。另一方面,脂質過氧化(LPO)是生命活動和食品加工中最常見也備受關注的生化進程。在活性氧的作用下,脂質中的多不飽和脂肪酸可逐漸裂解形成各種脂質衍生親電體(LDEs),這些LDEs可對蛋白質中的親核殘基,如賴氨酸、半胱氨酸和組氨酸進行共價修飾,從而造成蛋白功能紊亂或食品品質下降。值得注意的是,在水-油界面體系中,LPO同樣被視為一種界面現象,因此作者們推測界面可能為LDEs對蛋白質的修飾作用提供獨特的微環境,從而引起蛋白界面行為的改變。
為驗證上述猜想,研究團隊以親電能力最強的α,β-不飽和醛為骨架,設計合成了帶有可點擊標簽的探針yne-ACR,模擬LDEs對蛋白的修飾作用。借助乳清蛋白-十六烷組成的水-油界面模擬體系,結合界面流體力學、化學蛋白質組學以及全原子分子動力學模擬等技術,系統解析了界面上LDEs對乳清蛋白的修飾作用及其界面行為的影響。實驗結果表明,LDEs對界面蛋白具有更顯著的修飾作用,被修飾蛋白在界面排布的穩定性下降,可在后續的剪切過程中脫離界面并在體相中形成蛋白聚集體。以上研究發現可為進一步理解界面在生物體內或食品加工過程中的重要作用提供新的視角。
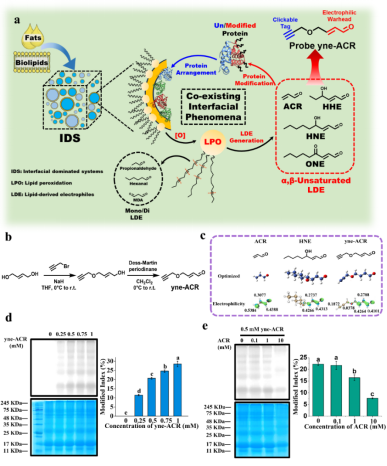
圖1 探針yne-ACR模擬典型LDE對WP的修飾作用
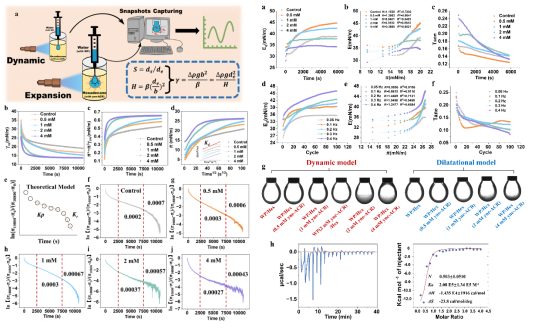
圖2 yne-ACR修飾改變了WP在界面處的界面行為
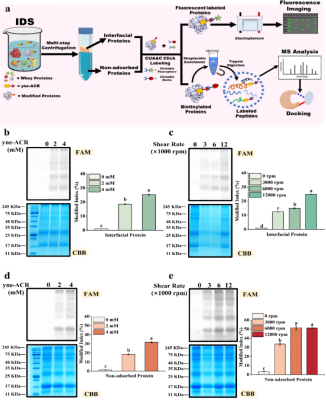
圖3 在IDS中,yne-ACR濃度的增加以及界面比表面積的增大促進了yne-ACR對界面和未吸附蛋白質的修飾作用
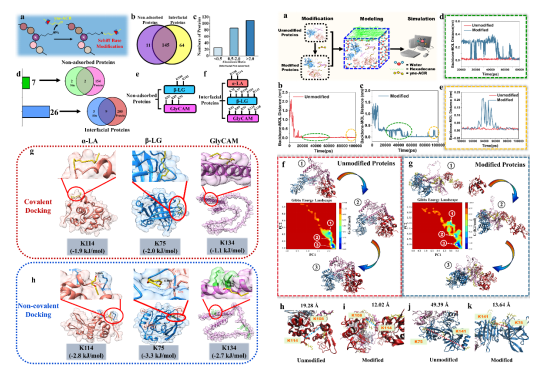
圖4 與未被吸附的蛋白相比,在界面蛋白中能夠檢測到更多種類的yne-ACR修飾蛋白、更多的修飾位點以及更高的修飾豐度,此外,全原子分子模擬結果表明yne-ACR修飾改變了界面周圍WP的聚集模式
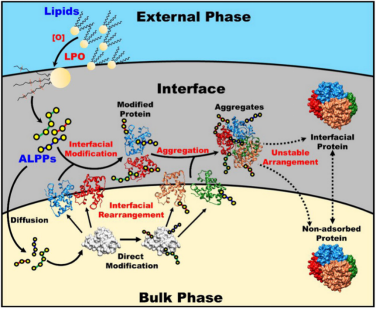
圖5 脂質過氧化產物誘導的蛋白修飾影響蛋白在IDS中界面行為的可能機制
文獻詳情
Gong W, Jiang K, Yang T-Q, et al. Lipid-Derived Electrophiles Modify Proteins and Alter Their Interfacial Behavior: The Distinct Mediating Role of the Interface [J]. ACS Nano, 2025, DOI: 10.1021/acsnano.4c17439
論文鏈接:https://pubs.acs.org/doi/10.1021/acsnano.4c17439





